Enfermedad Pulmonar Obstrutiva Crónica (EPOC)

La EPOC es una enfermedad pulmonar de alta prevalencia y potencialmente mortal que se encuentra entre las principales causas de muerte y discapacidad a nivel mundial; sin embargo, suele estar infradiagnosticada y existen muchas necesidades no satisfechas para su tratamiento1-3.
PART 1
Comprensión de la EPOC
¿Qué es la EPOC?
La enfermedad pulmonar obstructiva crónica (EPOC) es una enfermedad pulmonar frecuente que limita el flujo de aire y genera dificultades para respirar que se van agravando progresivamente.
Global Initiative for Chronic Obstructive Lung Disease (GOLD) define la EPOC como una enfermedad pulmonar heterogénea que se caracteriza por síntomas respiratorios crónicos provocados por alteraciones en las vías respiratorias y/o los alvéolos, lo que provoca una obstrucción persistente y, a menudo, progresiva del flujo de aire3.
Principales síntomas
Entre los síntomas se incluyen la disnea, la tos y la expectoración.
A pesar de que la EPOC es una enfermedad crónica, un número sustancial de pacientes sufren exacerbaciones agudas de la EPOC, que GOLD define como eventos caracterizados por un aumento de la disnea y/o tos y la expectoración que presentan un empeoramiento en menos de 14 días y pueden ir acompañados de taquipnea y/o taquicardia, y que suelen estar asociados con una inflamación localizada y sistémica progresiva y causada por una infección, contaminación u otro factor agresivo para las vías respiratorias3.
Los datos obtenidos de diversas cohortes de pacientes indican que hasta el 70 % de los pacientes experimentan al menos una exacerbación aguda durante un período posterior de entre 1 y 5 años4.
Las exacerbaciones agudas suelen requerir atención urgente, un aumento gradual de la medicación y/u hospitalización, lo que conlleva importantes costes adicionales5.
Fisiopatología
Se cree que la causa de la EPOC es una mezcla de factores genéticos y ambientales; más en concreto, el tabaquismo y la exposición a contaminación (exposición profesional y a contaminación en interiores asociada a la quema de madera y otros combustibles de biomasa)3.
Dado que la EPOC es una enfermedad heterogénea, un grupo de especialistas recomienda clasificar la EPOC en función de los mecanismos causantes subyacentes para desarrollar estrategias personalizadas de tratamiento2.
Carga de la enfermedad
La EPOC genera una importante carga económica1 y social6, 7.
La EPOC afecta a la calidad de vida y el bienestar mental del paciente: la EPOC está asociada con un estado físico y un estado de salud específico de la enfermedad peores (en comparación con las personas sin EPOC)8, así como con una elevada incidencia de enfermedades concomitantes psiquiátricas9, incluida la depresión10, 11.
La EPOC es la tercera principal causa de mortalidad a nivel mundial y la séptima principal causa de morbilidad12.
Los pacientes con EPOC están expuestos al riesgo de hospitalizaciones frecuentes que, a menudo, están asociadas con malestar psíquico: casi uno de cada cinco pacientes que acuden al servicio de urgencias requieren hospitalización al menos una vez durante el año siguiente a la visita inicial13.
Las exacerbaciones agudas por EPOC están asociadas con un deterioro de la función pulmonar14, un empeoramiento de la calidad de vida15, 16, una reducción de la actividad física17, depresión18, hospitalizaciones, otras exacerbaciones agudas y mortalidad19, 20.
Enfermedades concomitantes
Existe una gran carga de enfermedades concomitantes, en especial de enfermedades cardiovasculares y diabetes3:
- Las más frecuentes son: hipertensión, arteriopatía coronaria, diabetes, artrosis, enfermedades psiquiátricas, asma y apnea obstructiva del sueño (AOS)21, 22.
- Las enfermedades concomitantes pueden afectar al estado clínico y al pronóstico del paciente y requerir tratamiento; algunas enfermedades, como la insuficiencia cardíaca, la cardiopatía isquémica, los trastornos del sueño y la depresión o la ansiedad están asociadas con exacerbaciones agudas de la EPOC3, 23. La AOS puede agravar la hipoxemia nocturna e incrementar el riesgo de hipertensión pulmonar22.
Deterioro del estado físico
El estado de salud de los pacientes con EPOC suele entrar en una «espiral descendente»: los efectos sistémicos producen enfermedades concomitantes cardiovasculares, atrofia muscular y osteoporosis, lo que se traduce en una inactividad y un deterioro físico aún mayores. Asimismo, las exacerbaciones provocan una pérdida de función pulmonar, inactividad física y un deterioro de la salud mental24.
Entender la EPOC: resumen

La EPOC es una enfermedad pulmonar progresiva cuya principal manifestación es la obstrucción del flujo de aire, y está asociada con una menor calidad de vida de los pacientes y un mayor riesgo de mortalidad. Así pues, ¿cómo de frecuente es la EPOC y cómo se diagnostica?
PART 2
Prevalencia y diagnóstico
Prevalencia
Aunque las estimaciones de prevalencia varían, se cree que alrededor de 480 millones de personas sufren EPOC a nivel mundial25. La incidencia aumentó más de un 85 % entre 1990 y 201926, y se prevé que siga aumentando en las próximas décadas debido a la exposición continua a factores de riesgo, al envejecimiento de la población y a la mejora del conocimiento sobre la enfermedad y el diagnóstico3.
Diagnóstico
Los signos y síntomas de la EPOC pueden variar en función del paciente y de un día a otro. Sin embargo, se debe valorar este diagnóstico para cualquier paciente que presente disnea persistente y tos crónica (intermitente o continua) con o sin expectoración, así como antecedentes de infecciones recurrentes de las vías respiratorias inferiores y/o exposición a factores de riesgo como el tabaquismo o la contaminación3.
El método de diagnóstico de referencia es la espirometría (presencia de restricciones en las vías respiratorias que no sean completamente reversibles, con una relación FEV1/FVC <0,7 tras la administración del broncodilatador), combinada con la anamnesis y la existencia de factores de riesgo3.
Entre las evaluaciones complementarias para excluir diagnósticos diferenciales se pueden incluir las técnicas de diagnóstico por la imagen (radiografía o TAC del pecho), la gasometría arterial (para detectar hipoxia o hipercapnia) y el examen de los esputos (que resulta útil en pacientes que presenten alguna EAEPOC)3.
Diagnóstico: necesidades no satisfechas
A nivel mundial, existe una gran variabilidad en los valores de prevalencia publicados de la EPOC, y entre un 10 y un 95 % de los pacientes están infradiagnosticados, a menudo debido al uso inadecuado o incoherente de los métodos de diagnóstico o a su falta de disponibilidad27, ya que hay pacientes que no disponen de acceso a centros de diagnóstico o atención sanitaria adecuados.
Los expertos han resaltado diversas debilidades en los métodos y criterios de diagnóstico actuales. La espirometría con broncodilatador no predice los síntomas y no detecta los cambios anatomopatológicos tempranos. Además, la espirometría se suele infrautilizar o malinterpretar. Un grupo de expertos ha propuesto que el uso de técnicas modernas, como las de diagnóstico por la imagen, puede permitir detectar casos leves de la enfermedad antes de que se produzcan cambios anatomopatológicos irreversibles2.
Clasificación de la gravedad
Como orientación para la estrategia de tratamiento, GOLD recomienda clasificar la EPOC según el nivel de obstrucción del flujo de aire (GOLD 1-4) y los antecedentes de síntomas y exacerbaciones3:
- El nivel de obstrucción del flujo de aire varía de leve (GOLD 1) a muy grave (GOLD 4) en función del valor calculado de FEV1.
- La gravedad de los síntomas abarca desde GOLD A (carga baja de síntomas: mMRC = 0-1 o CAT <10; pocos antecedentes de exacerbaciones: exacerbaciones moderadas ≤1) y GOLD B (carga elevada de síntomas: mMRC ≥2 o CAT ≥10; pocos antecedentes de exacerbaciones: exacerbaciones moderadas ≤1) hasta GOLD E (cualquier carga de síntomas; riesgo elevado de exacerbaciones: exacerbaciones moderadas ≥2 o exacerbaciones que conlleven hospitalización ≥1).
Prevalencia y diagnóstico: resumen

La EPOC es una enfermedad pulmonar heterogénea y de alta prevalencia. A pesar de que los síntomas pueden ser variables, el método de referencia para el diagnóstico es la relación FEV1/FVC con broncodilatador. Los antecedentes de exacerbaciones y la carga de síntomas también se evalúan para determinar la gravedad de la enfermedad. Así pues, ¿cómo se emplea la clasificación de la gravedad para fundamentar la elección del tratamiento?
PART 3
Tratamiento y pronóstico
Objetivos del tratamiento
La elección del tratamiento para la EPOC depende de la gravedad de la enfermedad* y tiene como objetivo aliviar los síntomas y, al mismo tiempo, reducir la progresión de la enfermedad, las exacerbaciones y la mortalidad.
Entre las intervenciones se incluyen: cambios de hábitos, tratamiento farmacológico y oxigenoterapia o ventilación asistida; por ejemplo, oxigenoterapia de larga duración y terapia de alto flujo (consulte la figura).
* El informe de GOLD de 2023 sobre la EPOC menciona tres grupos según la gravedad de los síntomas: «A», «B» y «E»3.
Directrices
La información incluida en las secciones siguientes no tiene como objeto reemplazar las directrices locales o las recomendaciones de las asociaciones de expertos. Consulte las directrices vigentes a nivel local o internacional para fundamentar las decisiones sobre el tratamiento. A continuación, se incluyen algunos enlaces útiles:
https://goldcopd.org/2023-gold-report-2
Cambios de comportamiento y hábitos
Entre los cambios de comportamiento y hábitos se incluyen el abandono del tabaco y la rehabilitación pulmonar (ejercicios combinados con educación del paciente).
Se ha demostrado que ambas estrategias reducen la mortalidad entre los pacientes con EPOC3.
Tratamientos farmacológicos
Los tratamientos farmacológicos pueden reducir los síntomas y la frecuencia y la gravedad de las EAEPOC, así como mejorar el estado de salud y la tolerancia al ejercicio3.
Los tratamientos se deben personalizar en función de la gravedad de los síntomas, el riesgo de exacerbaciones, los efectos secundarios, las enfermedades concomitantes de los pacientes y el coste y la disponibilidad de los fármacos, así como según las preferencias del paciente3.
GOLD recomienda el uso de broncodilatadores por vía inhalatoria como un aspecto esencial para el tratamiento de los síntomas; estos fármacos sirven para relajar los músculos lisos de las vías respiratorias o evitar su contracción3.
Se pueden recetar antibióticos a los pacientes durante el transcurso de las exacerbaciones agudas de la EPOC, o bien para prevenirlas28, 29. También se pueden administrar vacunas a los pacientes para prevenir infecciones que puedan derivar en exacerbaciones agudas3.
Los mucolíticos reducen el riesgo de exacerbaciones agudas en algunos pacientes, y la ERS y la ATS los recomiendan para aquellos pacientes con limitación moderada o grave del flujo de aire o exacerbaciones agudas de la EPOC a pesar de la administración del tratamiento óptimo por vía inhalatoria3, 29.
Oxigenoterapia
La oxigenoterapia puede aliviar la hipoxemia y lograr que la respiración resulte menos fatigosa. La oxigenoterapia de larga duración se debe reevaluar periódicamente, y GOLD y la ATS la recomiendan para pacientes con hipoxemia grave en reposo, en los que está asociada con un leve incremento de la supervivencia3, 30, 31.
El oxígeno se puede administrar mediante un concentrador de oxígeno, un cilindro de oxígeno comprimido o líquido, o bien un ventilador.
Terapia de alto flujo (TAF)
La TAF consiste en la administración de una mezcla de aire humidificado y tibio, con o sin oxígeno, y puede resultar beneficiosa para pacientes con tos y producción de mucosidad crónicas, unos síntomas cuyo tratamiento puede resultar difícil usando solamente terapias convencionales32.
La TAF está diseñada para administrarse a través de una cánula nasal de alto flujo (CNAF). La TAF domiciliaria permite administrar un caudal de 10-60 l/min, o bien de 10-15 l/min si se añade oxígeno. La configuración utilizada dependerá de las necesidades del paciente.
Entre los beneficios de la TAF se incluyen la mejora del tratamiento de las secreciones33, la reducción de la disnea34-36 y del espacio muerto37, la mejora de la comodidad del paciente33, 37 y la reducción de las EAEPOC32, 38.
Puede encontrar más información sobre la TAF aquí y sobre los beneficios de la TAF para los pacientes con EPOC aquí.
Ventilación no invasiva (NIV) domiciliaria
GOLD y la ERS recomiendan la NIV para pacientes estables con hipercapnia crónica grave y antecedentes de hospitalización por insuficiencia respiratoria aguda3, 39-41.
- Entre los beneficios se incluyen la mejora de la supervivencia y la calidad de vida y la reducción del riesgo de hospitalización39, 40.
- Tras una exacerbación aguda de la EPOC, se ha comprobado que la combinación de la NIV con oxigenoterapia domiciliaria alarga sensiblemente el tiempo hasta la hospitalización o la muerte, reduce otras exacerbaciones agudas40 y ofrece una buena relación coste-eficacia42.
- Los datos de los ensayos clínicos resaltan la importancia de la evaluación cuidadosa del fenotipo de los pacientes y de la programación y la administración de la NIV domiciliaria para garantizar la selección de aquellos pacientes para los que sea más probable que resulte beneficiosa43.
Prácticas óptimas para la NIV domiciliaria
Entre las consideraciones relativas a las prácticas óptimas para la NIV domiciliaria se incluyen la selección cuidadosa de aquellos pacientes que sea más probable que se beneficien del tratamiento, la administración de una terapia eficaz y que ofrezca una tolerancia adecuada y el seguimiento cuidadoso de los efectos del tratamiento.
La mejora de los niveles elevados de dióxido de carbono arterial debe ser uno de los objetivos principales de la NIV domiciliaria, y los datos de los ensayos clínicos muestran que las presiones inspiratorias más elevadas contribuyen al éxito de la terapia de NIV domiciliaria39, 40, 44.
Puede obtener más información sobre las prácticas óptimas para la NIV domiciliaria aquí
NIV para eventos agudos
GOLD también recomienda la NIV para el tratamiento de las exacerbaciones agudas de la EPOC cuando exista acidosis respiratoria o disnea grave con signos clínicos que indiquen fatiga de los músculos respiratorios o hipoxemia persistente a pesar del aporte complementario de oxígeno3.
La ERS y la ATS recomiendan la NIV para casos de insuficiencia respiratoria aguda con hipercapnia crónica provocados por exacerbaciones agudas de EPOC28.
Relación coste-eficacia del inicio de la NIV en el domicilio en lugar de en el hospital
La relación coste-eficacia de la NIV resulta especialmente positiva cuando se inicia en el domicilio, en comparación con el inicio en el hospital (consulte la figura)45.
En el Reino Unido, la combinación de VNI y oxigenoterapia doméstica es probable que ofrezca una buena relación coste-eficacia en los pacientes con hipercapnia persistente tras una EAEPOC potencialmente mortal (consulte la tabla).
Elección de la LTOT, la TAF o la VNI
La LTOT, la TAF domiciliaria y la VNI domiciliaria pueden usarse por separado o combinadas para el tratamiento domiciliario de pacientes con EPOC. Algunos de los beneficios de cada una de las estrategias se presentan en esta tabla.
Presión positiva continua en las vías respiratorias (CPAP)
La CPAP también puede resultar beneficiosa para algunos pacientes y ha demostrado que mejora la supervivencia y reduce el riesgo de hospitalización en pacientes con EPOC y apnea obstructiva del sueño3.
Cirugía
Entre las opciones quirúrgicas se incluyen la reducción del volumen pulmonar, la bullectomía y el trasplante pulmonar.
Pronóstico
A pesar de que la EPOC es una enfermedad progresiva, un tratamiento adecuado puede reducir los síntomas y la frecuencia y la gravedad de las exacerbaciones, así como mejorar el estado de salud y la tolerancia al ejercicio3.
Algunos tratamientos también pueden reducir la velocidad de deterioro funcional y la mortalidad3.
La oxigenoterapia de larga duración ha demostrado que mejora la supervivencia en pacientes con hipoxemia grave en reposo; asimismo, la VNI reduce la mortalidad y previene la hospitalización en pacientes con hipercapnia crónica grave3.
Si no se trata, la EPOC puede provocar una insuficiencia respiratoria aguda o crónica. Los pacientes se ven especialmente expuestos a riesgos durante una exacerbación aguda de la EPOC, ya que el incremento de la obstrucción de las vías respiratorias hace que el sistema respiratorio sea vulnerable a una sobrecarga.
Perspectivas de futuro
Existe una urgente necesidad de actuaciones adicionales para abordar la EPOC a nivel mundial46.
Un grupo de especialistas que escribe para la revista The Lancet señala que una respuesta internacional coordinada (tal como se hizo en el caso de la COVID-19) puede permitir superar las barreras existentes para el tratamiento y obtener resultados con rapidez. En concreto, abogan por lo siguiente2:
- Estrategias de salud pública para prohibir el tabaco y mantener limpio el aire.
- Una estrategia médica personalizada, basada en una evaluación completa de los aspectos fisiopatológicos y los síntomas de la enfermedad, así como de las necesidades, capacidades y preferencias de los pacientes.
- Mayores inversiones en terapias curativas y regenerativas que vayan más allá de las opciones de tratamiento mayormente sintomáticas.
- Mayor atención a las EAEPOC que desempeñan un papel esencial en la progresión y los costes de la enfermedad, pero que tienden a definirse de forma imprecisa y a investigarse de manera insuficiente.
Lea la infografía para obtener más información sobre algunas de las principales necesidades no satisfechas en cuanto al tratamiento de la EPOC.
Tratamiento y pronóstico: resumen

La EPOC es una enfermedad progresiva que afecta sensiblemente a la calidad de vida del paciente, así como una de las principales causas de morbilidad y mortalidad a nivel mundial3, 6, 12. Sin embargo, se ha demostrado que un tratamiento adecuado permite mejorar los síntomas, la frecuencia y la gravedad de las exacerbaciones agudas de la EPOC3, 32 y, en pacientes con EPOC e hipercapnia crónica tratados con ventilación no invasiva, la supervivencia39.
La voz del experto
Entrevista al Dr. Chris Carlin
¿Pueden los modos automáticos y el seguimiento remoto favorecer y simplificar las vías de administración de la VNI y una asistencia de buena calidad en pacientes con EPOC y SHO?
Entrevista al Prof. González-Bermejo
Cómo utilizar la VNI de alta intensidad en pacientes domiciliarios con EPOC.
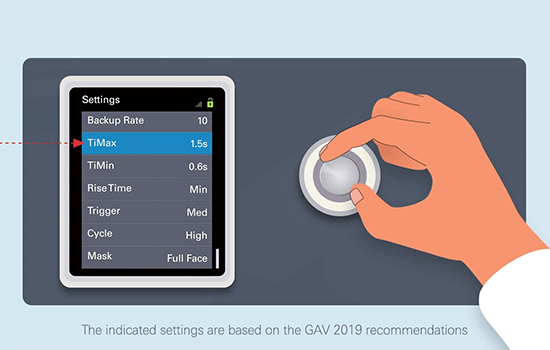
Recomendaciones prácticas para el uso de la VNI domiciliaria**
Estes vídeos acerca da utilização da VNI no domicílio destinam-se apenas a profissionais de saúde.
Descubra más información

Enfermedades neuromusculares (ENM)
El concepto de enfermedades neuromusculares (ENM) es muy amplio y abarca numerosas enfermedades y trastornos que afectan a la función muscular, ya sea de forma directa (a través de enfermedades intrínsecas de los músculos) o indirectamente (a través de enfermedades de los nervios).

Síndrome de hipoventilación por obesidad (SHO)
Descubra más sobre esta enfermedad, incluidos aspectos como su prevalencia, la forma en la que se diagnostica y las opciones de tratamiento que hay disponibles.

Clinical Respiratory News
ResMed cambia las vidas de las personas gracias a productos sanitarios y revolucionarias aplicaciones de software en la nube que han sido galardonados con distintos premios y permiten diagnosticar, tratar y abordar los trastornos respiratorios del sueño (TRS), la enfermedad pulmonar obstructiva crónica (EPOC) y otras enfermedades respiratorias crónicas.
Este contenido está destinado únicamente a profesionales de la salud.
** Estos videotutoriales sobre el uso de la VNI domiciliaria están destinados únicamente a los profesionales sanitarios y se basan en las recomendaciones del GAV de 2019, que están basadas a su vez en las referencias bibliográficas y las aportaciones de neumólogos expertos. El protocolo asistencial es siempre responsabilidad del médico prescriptor y los parámetros de los aparatos se deben seleccionar tomando en consideración las necesidades de cada paciente.
Referencias
- Iheanacho, I., et al., Economic Burden of Chronic Obstructive Pulmonary Disease (COPD): A Systematic Literature Review. Int J Chron Obstruct Pulmon Dis, 2020. 15: p. 439-460.
- Stolz, D., et al., Towards the elimination of chronic obstructive pulmonary disease: a Lancet Commission. Lancet, 2022. 400(10356): p. 921-972.
- Global Initiative for Chronic Obstructive Lung Disease. Global Strategy for the Prevention, Diagnosis and Management of COPD: 2023 Report 2023. Available at https://goldcopd.org/2023-gold-report-2/
- Hoogendoorn, M., et al., Prediction models for exacerbations in different COPD patient populations: comparing results of five large data sources. Int J Chron Obstruct Pulmon Dis, 2017. 12: p. 3183-3194.
- Dalal, A.A., et al., Impact of COPD Exacerbation Frequency on Costs for a Managed Care Population. J Manag Care Spec Pharm, 2015. 21(7): p. 575-83.
- Svedsater, H., et al., Life Impact and Treatment Preferences of Individuals with Asthma and Chronic Obstructive Pulmonary Disease: Results from Qualitative Interviews and Focus Groups. Adv Ther, 2017. 34(6): p. 1466-1481.
- Cook, N.S., et al., Patients’ perspectives on COPD: findings from a social media listening study. ERJ Open Res, 2019. 5(1).
- Franssen, F.M.E., et al., The physical, mental, and social impact of COPD in a population-based sample: results from the Longitudinal Aging Study Amsterdam. NPJ Prim Care Respir Med, 2018. 28(1): p. 30.
- FitzGerald, J.M., et al., Resource use study in COPD (RUSIC): a prospective study to quantify the effects of COPD exacerbations on health care resource use among COPD patients. Can Respir J, 2007. 14(3): p. 145-52.
- Omachi, T.A., et al., Depression and health-related quality of life in chronic obstructive pulmonary disease. Am J Med, 2009. 122(8): p. 778 e9-15.
- Zhang, M.W., et al., Prevalence of depressive symptoms in patients with chronic obstructive pulmonary disease: a systematic review, meta-analysis and meta-regression. Gen Hosp Psychiatry, 2011. 33(3): p. 217-23.
- GBD 2019 Diseases and Injuries Collaborators, Global burden of 369 diseases and injuries in 204 countries and territories, 1990-2019: a systematic analysis for the Global Burden of Disease Study 2019. Lancet, 2020. 396(10258): p. 1204-1222.
- Yeatts, K.B., et al., Population-based burden of COPD-related visits in the ED: return ED visits, hospital admissions, and comorbidity risks. Chest, 2013. 144(3): p. 784-793.
- Donaldson, G.C., et al., Relationship between exacerbation frequency and lung function decline in chronic obstructive pulmonary disease. Thorax, 2002. 57(10): p. 847-52.
- Miravitlles, M., et al., Effect of exacerbations on quality of life in patients with chronic obstructive pulmonary disease: a 2 year follow up study. Thorax, 2004. 59(5): p. 387-95.
- Seemungal, T.A., et al., Effect of exacerbation on quality of life in patients with chronic obstructive pulmonary disease. Am J Respir Crit Care Med, 1998. 157(5 Pt 1): p. 1418-22.
- Ehsan, M., et al., A longitudinal study evaluating the effect of exacerbations on physical activity in patients with chronic obstructive pulmonary disease. Ann Am Thorac Soc, 2013. 10(6): p. 559-64.
- Alahmari, A.D., et al., Physical activity and exercise capacity in patients with moderate COPD exacerbations. Eur Respir J, 2016. 48(2): p. 340-9.
- Suissa, S., S. Dell’Aniello, and P. Ernst, Long-term natural history of chronic obstructive pulmonary disease: severe exacerbations and mortality. Thorax, 2012. 67(11): p. 957-63.
- Connors, A.F., Jr., et al., Outcomes following acute exacerbation of severe chronic obstructive lung disease. The SUPPORT investigators (Study to Understand Prognoses and Preferences for Outcomes and Risks of Treatments). Am J Respir Crit Care Med, 1996. 154(4 Pt 1): p. 959-67.
- Santos, N.C.D., et al., Prevalence and Impact of Comorbidities in Individuals with Chronic Obstructive Pulmonary Disease: A Systematic Review. Tuberc Respir Dis (Seoul), 2022. 85(3): p. 205-220.
- Soler, X., et al., High Prevalence of Obstructive Sleep Apnea in Patients with Moderate to Severe Chronic Obstructive Pulmonary Disease. Ann Am Thorac Soc, 2015. 12(8): p. 1219-25.
- Stallberg, B., et al., Real-world retrospective cohort study ARCTIC shows burden of comorbidities in Swedish COPD versus non-COPD patients. NPJ Prim Care Respir Med, 2018. 28(1): p. 33.
- Hurst, J.R., et al., Understanding the impact of chronic obstructive pulmonary disease exacerbations on patient health and quality of life. Eur J Intern Med, 2020. 73: p. 1-6.
- Boers, E., et al. An estimate of the global COPD prevalence in 2050: Disparities by income and gender. Poster presented at the European Respiratory Society International Congress 2022. Barcelona, Spain.
- Li, H.Y., et al., Global, regional and national burden of chronic obstructive pulmonary disease over a 30-year period: Estimates from the 1990 to 2019 Global Burden of Disease Study. Respirology, 2023. 28(1): p. 29-36.
- Ho, T., et al., Under- and over-diagnosis of COPD: a global perspective. Breathe (Sheff), 2019. 15(1): p. 24-35.
- Wedzicha, J.A.E.C.-C., et al., Management of COPD exacerbations: a European Respiratory Society/American Thoracic Society guideline. Eur Respir J, 2017. 49(3).
- Wedzicha, J.A., et al., Prevention of COPD exacerbations: a European Respiratory Society/American Thoracic Society guideline. Eur Respir J, 2017. 50(3).
- Jacobs, S.S., et al., Home Oxygen Therapy for Adults with Chronic Lung Disease. An Official American Thoracic Society Clinical Practice Guideline. Am J Respir Crit Care Med, 2020. 202(10): p. e121-e141.
- Cranston, J.M., et al., Domiciliary oxygen for chronic obstructive pulmonary disease. Cochrane Database Syst Rev, 2005. 2005(4): p. CD001744.
- Storgaard, L.H., et al., Long-term effects of oxygen-enriched high-flow nasal cannula treatment in COPD patients with chronic hypoxemic respiratory failure. Int J Chron Obstruct Pulmon Dis, 2018. 13: p. 1195-1205.
- Hasani, A., et al., Domiciliary humidification improves lung mucociliary clearance in patients with bronchiectasis. Chron Respir Dis, 2008. 5(2): p. 81-6.
- Cirio, S., et al., Effects of heated and humidified high flow gases during high-intensity constant-load exercise on severe COPD patients with ventilatory limitation. Respir Med, 2016. 118: p. 128-132.
- Neunhauserer, D., et al., Supplemental Oxygen During High-Intensity Exercise Training in Nonhypoxemic Chronic Obstructive Pulmonary Disease. Am J Med, 2016. 129(11): p. 1185-1193.
- Chatila, W., et al., The effects of high-flow vs low-flow oxygen on exercise in advanced obstructive airways disease. Chest, 2004. 126(4): p. 1108-15.
- Fraser, J.F., et al., Nasal high flow oxygen therapy in patients with COPD reduces respiratory rate and tissue carbon dioxide while increasing tidal and end-expiratory lung volumes: a randomised crossover trial. Thorax, 2016. 71(8): p. 759-61.
- Rea, H., et al., The clinical utility of long-term humidification therapy in chronic airway disease. Respir Med, 2010. 104(4): p. 525-33.
- Kohnlein, T., et al., Non-invasive positive pressure ventilation for the treatment of severe stable chronic obstructive pulmonary disease: a prospective, multicentre, randomised, controlled clinical trial. Lancet Respir Med, 2014. 2(9): p. 698-705.
- Murphy, P.B., et al., Effect of Home Noninvasive Ventilation With Oxygen Therapy vs Oxygen Therapy Alone on Hospital Readmission or Death After an Acute COPD Exacerbation: A Randomized Clinical Trial. JAMA, 2017. 317(21): p. 2177-2186.
- Ergan, B., et al., European Respiratory Society guidelines on long-term home non-invasive ventilation for management of COPD. Eur Respir J, 2019. 54(3).
- Murphy, P.B., et al., Cost-effectiveness of home non-invasive ventilation in patients with persistent hypercapnia after an acute exacerbation of COPD in the UK. Thorax, 2023. 78(5): p. 523-525.
- Murphy, P.B. and N. Hart, Home Non-Invasive Ventilation for COPD: How, Who and When? Arch Bronconeumol (Engl Ed), 2018. 54(3): p. 149-154.
- Windisch, W., J.H. Storre, and T. Kohnlein, Nocturnal non-invasive positive pressure ventilation for COPD. Expert Rev Respir Med, 2015. 9(3): p. 295-308.
- Duiverman, M.L., et al., Home initiation of chronic non-invasive ventilation in COPD patients with chronic hypercapnic respiratory failure: a randomised controlled trial. Thorax, 2020. 75(3): p. 244-252.
- Halpin, D.M.G., et al., It is time for the world to take COPD seriously: a statement from the GOLD board of directors. Eur Respir J, 2019. 54(1).